مکانیسم های اولیه واکنش های جایگزینی در سری های آلیفاتیک و آروماتیک. واکنش های جانشینی رادیکال SR، مکانیسم їkh. گزینش پذیری واکنش ها و قدرت رادیکال های آلکیل. مکانیسم اکسیداسیون آلکان. مکانیسم آلکان های سولفونیل کلرید
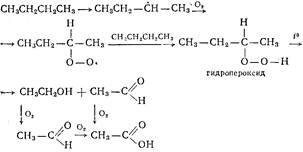
کل مکانیسم عدالت نه تنها برای آلکان ها، بلکه برای دیگران است. z'єdnan، scho برای انتقام از رادیکال های alkilny. کیا نار. در برابر بعدی خز .: іnіtsіyuvannya lantsyuga nar. Cl2 → hv 2Cl مرحله 1; در حال رشد lantsyuga CH4 + Cl → CH3 + H-Cl مرحله 2. مرحله 3 CH3 + Cl2 → CH3-Cl + Cl. سپس مراحل 2،3 اغلب تکرار می شوند. مرحله 1. Іnіtsіyuvannya lantsyuga nar. ابتکار R. از تقسیم مول به اتم، انرژی لازم است تا گرما با نور ماوراء بنفش گرم شود. U tsomu e، تصویر. پیوندها، از یک اوربیتال ارتعاشی به یک اوربیتال شلیک، و یک سقوط mol-la به یک اتم بروید: Cl. : Cl → hvCl + Cl. مراحل 2 و 3. توسعه لانسوگ. دید انرژی اتم بر روی تصویر تحقق می یابد. شیمی جدید هنگامی که قطع می شود و با ذرات دیگر دراز می کشد (mol-mi). روی یک تخته تخت. کارآمدترین اتصال با متان مول-لوی. Tse zitknennya برای ایجاد یک تصویر. رادیکال جدیدی که اسید هیدروکلریک است. تصویر فعال mіtilny رادیکال برای تکمیل اکتت تصویر پراگن. تماس جدید در میان جوان ترین گزینه ها برای سوارکاری. ذرات اثری از اتصال با مول کلر و متان (ارتباط با رادیکال ها کم است، اما اتصال کم است). رادیکال Zustrіch mіtil با متان mol-loy بی اثر است، زیرا تولید تا جایگزینی یک رادیکال برای همان رادیکال. این امر برهمکنش رادیکال متیل را با موللی کلر (CH3 + Cl : Cl → CH3-Cl + Cl). Vikoristannya در نار. یک بخش واکنشی (Cl) توسط ظاهر یکی از این قطعات، کیت نظارت می شود. به مولو متان حمله کند. تصویر در همان زمان، رادیکال متیل (مرحله 2) به کلر حمله می کند (مرحله 3). مراحل Tsi r. من خودم را بارها تکرار می کنم. چنین nar. نام را حذف کرد لانتسیوگوویخ لانتسیوگوی آر. - به او. بازبینی، روی کیت ظاهر یک بخش فعال میانی (رادیکال) wiklikє تعداد زیادی (lantsyug) تولید مجدد غیرفعال برونگرا... مراحل 4، 5، 6. تراشیدن لنسر. مثلاً در دنیای ویتراکشن کلی امور برون گرا. بهینه سازی اضافی گرمایش قطعات واکنش شناخته شده است. تسه تبدیل شده است. در res. نیمی از 2 ذره فعال: Cl + Cl → Cl2 مرحله 4. CH3 + CH3 → CH3-CH3 مرحله 5; CH3 + Cl → CH3-Cl مرحله 6. رادیکال متیل، تصویر. u qich r. من هستم. mayzhe flat budov: اتم در زغال سنگ ناه. در sp2-hybrid، هر 4 اتم rozp. mayzhe در همان منطقه، غیر جفت و با فاصله روی غیر هیبریدی r-orb.، کیت. عمود بر مساحت همه مولی ها. گزینش منطقه ای - سرریز از یک طرف در یک زمان. mechanizm_v. تصویر در تخت های دو طبقه رادیکال های قلیایی ممکن است کارایی پایینی داشته باشند، کیت. zmensch. در ردیف: سوم> دوم> اول> CH3. پایداری رادیکال ها جابجایی جفت نشده E. جابجایی جفت نشده r-e zdіysn. برای rakhunok suprazvyazka (hypercon'yugatsії) با پیوندهای C-H. برای چنین صداهای بیشتری، سپس Eph. به آن رادیکال قوی کمک کنید. در درب اول، سمت راست. جفت نشده e zdіysn. mіzh سه اتم (1C و 2H). دیلوک. در im ثانویه mіzh 6 H و 1 C.
Sulfochloruvannya: ورودی. تمام الکانی R. ida در اتاق T، به موجب آن انتخاب اتم N برای پوشیدن obir. حر-ر: اتمی ن، مقید با ثانویه، معاون. پانسمان سبک تر، nіzh. از اول، و از سوم، تماس جایگزین نیست.
اکسیداسیون: در حضور مقدار زیادی O (povitrya) با آلکان T بالا می سوزند و اکسید کربن را هدایت می کنند. ذهن می توان اکسیداسیون کنترل شده را با کیت انجام داد. شبیه بودن شکافتن تنها بخشی از پیوندهای C-C با اتم های اکسید شده غیربرابر، که می تواند به یک تصویر منتقل شود. اندام مهم sysnevm_snyh. s'єdn.: الکل، آلدهید، کتون و کربن. به-t.
سیکلوآلکانی. کیفیت چرخه تیپی در چرخه چشمه می زند. ایزومرهای پیکربندی و منسجم سیکلوآلکان ها. نامگذاری سیکلوآلکان چرخه های کوچک بودوا. ایزومریا شواهدی از قدرت های گستاخانه چرخه های کوچک و متوسط. ماهیت صدا و قدرت شیمیایی سیکلوپروپان و سیکلوبوتان را درک کنید.
سیکلوآلکانی، سیکلوپارافین - اشباع حلقوی در کربوهیدرات ها، مقامات گستاخنزدیک به کربوهیدرات های مرزی وارد انبار نفتا شوید. در صنعت نفتوشیمی نفتنیا، تسلط آروماتیک در کربوهیدرات ها در راه رفرمینگ کاتالیزوری یک معضل است. عملی ترین ارزش آن با سیکلوهگزان است که برای سنتز کاپرولاکتام، اسید آدیپیک و سایر اسپولوک ها استفاده می شود که می توان از الیاف مصنوعی به دست آورد. قبل از سیکلوآلکان ها، آنها مرز کربوهیدرات ها را از فرمول خارجی СnH2n حمل می کنند که ممکن است منجر به مشکلات حلقوی شود. نام سیکلوآلکان ها از نام آلکان های مرتبط با افزودن پیشوند سیکلو مشتق شده است، به عنوان مثال، سیکلوپروپان، 1،3-دی متیل سیکلوهگزان. برای سیکلوآلکان ها انواع ایزومرهای زیر مشخص است: 1. ایزومری اسکلت کربنی
2. Prostorova (cis-، trans-isomeria) 3. Mizhclasova ایزومری با آلکن. 4) اندازه هسته ها؛ 5) ارزش رادیکال ها (متامریسم). اتم های کربن موجود در مولکول های سیکلوآلکان ها ممکن است باعث هیبریداسیون sp3 شوند. با این حال، اندازه برشهای بین اوربیتال هیبریدی در سیکلوبوتان و بهویژه در سیکلوپروپان 109 درجه 28 اینچ نیست، بلکه از نظر هندسی کمتر است، اما چرخههای کمتر حتی واکنشگرتر وجود دارد. دو عضو در یک ردیف (C3 - C4) - گازها، (C5 - C16) - خطوط، ترمیم از C17 - گفتار جامد از "رشد جرم مولی، دمای ذوب نیز افزایش می یابد. برای شیمی قدرت، چرخه کوچک و بزرگ سوتووو رشد می کند. سیکلوهگزان، به دلیل رفتار شیمیایی خود، نزدیک به آغاز واکنش است. هنگام گرم کردن در حضور کاتالیزور نیکل احترام بگذارید: С4Н8 + Н2 → СН3-СН2-СН2-СН3. چرخه های 3،4-malі. اولین. rahuє.، scho vcarbohydrate. اتمی سیکلیو روزپ. در یک منطقه Zvidsy vipliv، shho valentnі kuti در چرخه های rіvnі. برای سیکلوپروپان 60 درجه، سیکلوبوتان 90 درجه، سیکلوپنتان 108 درجه، سیکلوهگزان 120 درجه. Bayyr visloviv غیر قانونی، scho زمانی که vіdhilennі valentnykh kutіv چرخه vinik. تنش، tobto. انرژی رشد mol-li. دنیای استرس. بایور پروپونوواو راهواتی. نیمی از تفاوت بین برش چهار وجهی و برش ظرفیتی حلقه مسطح (£). با این حال، با viv. گرما zgoryannya buli otrimanі ін. دنی: استخدام گرما zgoryannya (در هر 1 گرم CH2) pos. سیکلوهگزان Tsі danі توضیح داد که در سیکلوهگزان گناهی ندارد اما بی گناه است. کوتیو ولنتاین از tetraedrich. C3H6 £ = 24◦، Q = 167; C4H8 £ = 9◦، Q = 164. سیکلوپروپان: هیبرید sp3، پیوند موز یا تاو - بیشینه بیش از حد انحنای مدارها. نه نه در مستقیم، z'єdn. هسته 2 اتمی، به آن مدار. پیچ خورده بی تفاوت، پیوند کووالانسی بین C-C آلمانی است و به راحتی پاره می شود. تنش را خودتان می بینید. پریس y سیکلوبوتان. سپس او ظاهر شد. فنر پیچشی صداهای بیرون زده یا کشش. پیتزر. زبیلشیتی. انرژی در قالب ارتباطات الکترونیکی در موقعیت مبهم (کم اهمیت.)
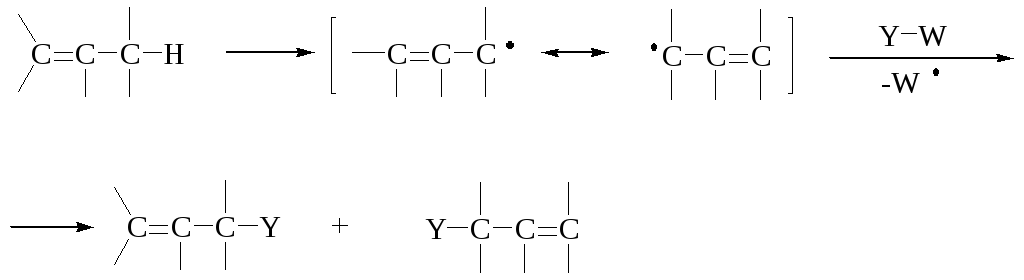
در واکنش جایگزینی رادیکال R-X R – Y اولین مرحله از شکافتن بستر R – X با رادیکال R است که به دو روش انجام می شود:
de W - آغازگر.
رادیکال R را می توان به دو طریق به محصول تبدیل کرد:
در واکنشهای نیمه وسط لانست، محصول وانمود میشود که راه خوبی برای بدست آوردن آن است (c) و نه مانند یک روش خوب برای نوترکیب (d). مراحل بسط به نوع (الف) میانگین اس اچ 1، و مرحله (ب) و (ج) به معنای اس اچ 2. واکنش ها را می توان به عنوان طبقه بندی کرد اس اچ 1 abo اس اچ 2 علاوه بر این که RX به R تبدیل می شود از طریق (الف) یا از طریق (ب).
مکانیسم واکنش با بسترهای معطر
در واکنش ها، طرح کلی به این صورت است:
یک شات ساده از یک پروتون را در پشت مدار مشاهده نکنید:
استقرار بیاریل ها با مکانیزمی توصیف می شود که شامل ایجاد یک واسطه است که توسط رزونانس تثبیت می شود:
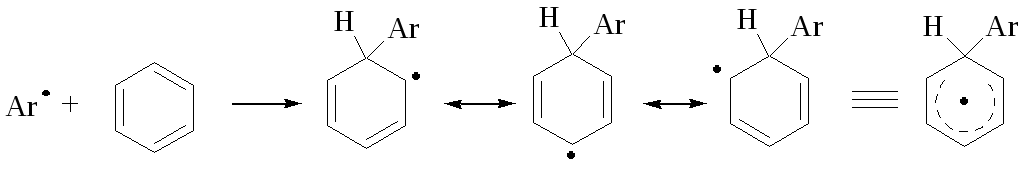
Intermediate بسیار سریع است و واکنش به سه روش از بین می رود:
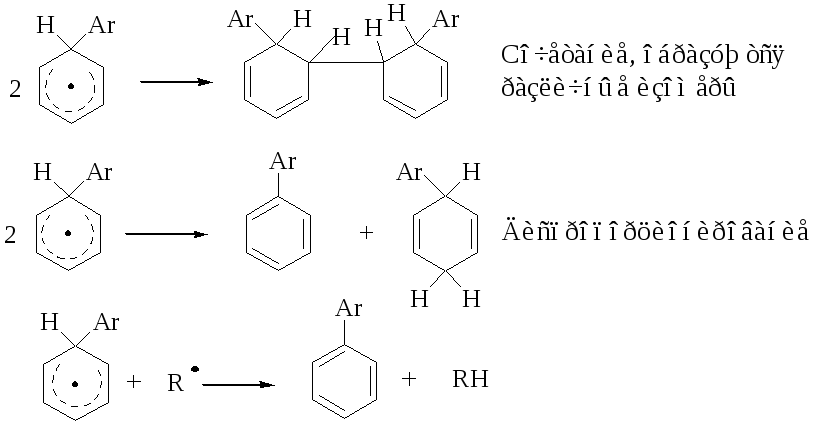
سرنوشت گروه های مشکوک در واکنش های رادیکال خشن
نشان داده شده است که در برخی موارد مراحل شکافتن و شکافتن، در حضور گروه های حساس نشان داده شده است. هالوژناسیون فوتولیتیک به شما امکان می دهد تا حداکثر محصولات را تولید کنید، پروتئین برومید موجود در لانس کربن، حتی برم کمتر، به سطح بالایی از انتخاب منطقه ای رسیده است. در مورد آلکیل برومید برمیده، جایگزینی آنتیک در سوسپانسیون با برم 85-95٪ است.
ناگزیر، انتخاب منطقه ای با مکانیسم تهاجمی توضیح داده می شود:
رادیکال را Br بنامید به شکل RH، رادیکال R را بدهید. همچنین، در مورد موقعیت خاصی از مولکول، یک اتم Br نیز در فرآیند ایجاد یک واسطه حلقوی وجود دارد. در مرحله kіntsevіy، چرخه آشکار می شود. از آنجایی که مکانیسم درست است، پیکربندی اتم در کربن مقصر خطا است که به خاطر حقیقت انجام شده است. اثر گروه های معلق ناشی از آن واکنش های جایگزینی رادیکال است.
واکنش های ساختمان در واکنش های جایگزینی رادیکال
در مرحله واکنش lantsyugov_، که شروع است، چه محصولی را می توان ایجاد کرد، اغلب مرحله I مطرح می شود. از آغاز رادیکال نیکولی، سه اتم سه ظرفیتی وجود ندارد، به دلیل خطای واکنش ها برای مشارکت سیستم های تحت تنش، و حتی به ندرت یک اتم دو ظرفیتی رشد می کند. بگذارید دیده شود، تا به عنوان یک اتم تک ظرفیتی دیده شود. بیایید آن را پروتون چی هالوژن بنامیم. به عنوان مثال، در واکنش اتان با رادیکال Cl ، اتم آب نیست، بلکه رادیکال متیل است.
دلیل اصلی استریک است. یک اتم تک ظرفیتی بیشتر توسط یک رادیکال ورودی مورد حمله قرار می گیرد، اما نه یک اتم با ظرفیت بالا. دلیل اصلی قطبیت این است که شکل یک اتم تک ظرفیتی بسیار پرانرژی است.
آلکانی... در آلکان ها، اتم سوم به آب تزریق می شود، سپس اتم دوم. مرحله بارگذاری مجدد به دلیل انتخابی بودن رادیکال و دما است.
گزینش پذیری تزریقی را می توان از لبه رادیکال های F і Br دید. برای اولین تعویض spіvvіdnoshennya در موقعیت اول و دوم 1: 1.4 و برای واکنش کمتر Br - 1: 16000.
با تحمیل عوامل فضایی، ماهیت گزینش پذیری می تواند تغییر کند. به عنوان مثال، با ایزوپنتان کلر فتوشیمیایی در شربت مالش-بوتیلامین و N-کلرو- مالش-بوتیل- مالش-پنتیلامین پروتون اولیه 1.7 برابر بیشتر از پروتون سوم است. یون رادیکال R2 + N H برای پر کردن حجم، اما برای حل کردن آن استریل دشوار است.
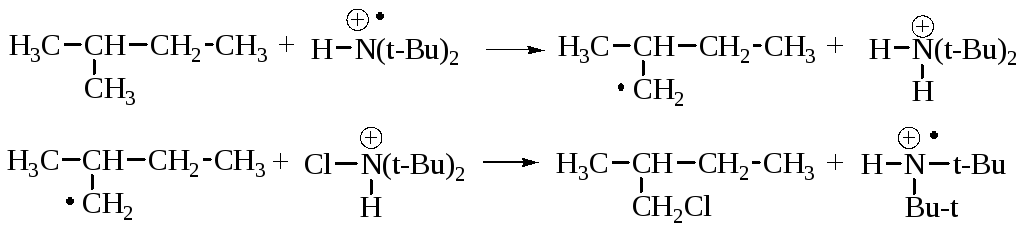
اولفینی... هنگامی که بسترها با کلر یا برم آغشته می شوند، به طوری که یک پیوند چندگانه جایگزین می شود، جایگزینی را فراخوانی کنید، اما آن را بپذیرید.
به محض رشد پروتون، جلوگیری از تشکیل اتم های وینیل در آب عملا غیرممکن است، زیرا پروتون متحد راحت تر رشد می کند و در قسمت های پایینی مولکول پایین تر می شود. در cich vipadkah ها، آنها مستعد گروه بندی بیش از حد آلیل هستند.
الکیلارنی.حمله لنسر bichesky مهم است که در موقعیت دوچرخه سوار دیده شود. اما هدف حمله با رادیکال های فعال و انتخابی تر است.
Z'єdnannya، برای انتقام از گروه های پذیرنده الکترونیکی... در مورد گروه های الکتروگیرنده هالوژنه، سوسپانسیون باید غیرفعال شود. بنابراین، برای نوع Z-CH 2 -CH 3، به هر دلیلی می توان از آن در موقعیت استفاده کرد. چنین اسپولوک هایی مانند CH 3 COOH وارد واکنش یک جایگزینی رادیکال نمی شوند، در مقابل یک الکتروفیلیک، در صورت هر گونه جایگزینی، همیشه در موقعیت قرار می گیرند. Tse توسط چنین مقاماتی توضیح داده خواهد شد. Yak vіdomo، ذرات، که ممکن است یک جفت الکترونیکی نباشد، ممکن است یک قدرت هسته دوست باشد، ذرات، که ممکن است مداری خالی با انرژی کم باشد، - elektrophilny. رادیکالها همچنین میتوانند توسط قدرتهای هسته دوست یا الکتروفیل ایجاد شوند، که عمدتاً به دلیل قدرت پذیرش الکتریکی اتم است که منجر به الکترونهای جفت نشده نمیشود. هالوژن ها є رادیکال های الکتروفیل و موقعیت shukayut با قدرت الکترونیکی بالا. رادیکالهای آلکیل، ناپاکها، ممکن است با کاهش قدرت الکترونیکی، باعث ایجاد قدرت هستهدوستی و تشکیل پروتونها شوند.
لب به لب جایگزینی از اسید پروپیونیک
CH 3 -CH 2 -COOH
CH 3 1: 7.8
Cl 1: 0,03
من نشان خواهم داد که من با یک جهان بزرگتر - موقعیت، و Cl - - موقعیت حمله می کردم.
بسترهای معطر... جایگزینی ویلنو رادیکال در بسترهای معطر حتی کمتر با مکانیسم تشکیل آب مخالف است:
مرا یک واسطه صدا کن:
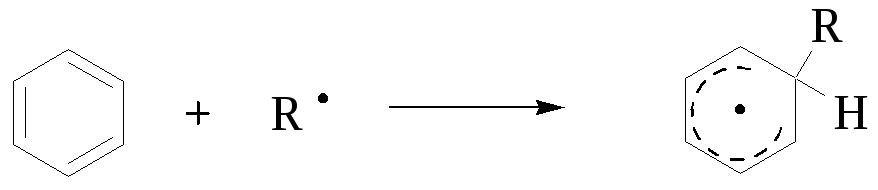
تزریق عوامل مختلف بر واکنش ساختمان در بسترهای معطر
1. همه مدافعان واکنش ساختمان را به جلو می راند ارتو- І جفت- موقعیت در سطح بنزن، نه حداقل به دلیل بوی الکترون دهنده یا گیرنده الکترون.
2. پاسخ از متا- موقعیت به دلیل ماهیت واسطه، که به سلامت واکنشی بنزن نزدیک است، دروغ نمی گوید.
3. پاسخ از ارتو- سوت بزن، نه در جفت- در پشت یک خط نقاشی، دو گروه بزرگ وجود دارد.
4. در ذهن رقابت bezposerednaya گروه های الکتروگیرنده، ممکن است جریان بیشتری وجود داشته باشد، الکترودونور کمتری وجود داشته باشد.
5. ورود واسطه ها به ناگاتو کمتر است، در واکنش ها کمتر اس نі اس E .
القای ماهیت رادیکال مهاجم در واکنش ساختمان
رادیکال ها برای ساختمان ارتجاعی خود فکر می کنند. در عین حال، واکنش کمتر انتخابی است و واکنش کمتر انتخابی تر است. همه رادیکالها به طور کلی خنثی هستند، بوی عطر آلر ممکن است بوی دنیای الکتریکی با قدرتهای الکتروفیل یا هستهدوست بدهد.
تاثیر بر ماهیت خرده فروش بر واکنش ساختمان
خرده فروش به طور ناچیز روی واکنش های جایگزینی رادیکال، بر روی نوع واکنش ها تأثیر می گذارد. با این حال، برای vipadkas deyakik، razchinnik را می توان در آن ریخت.
مثلا:
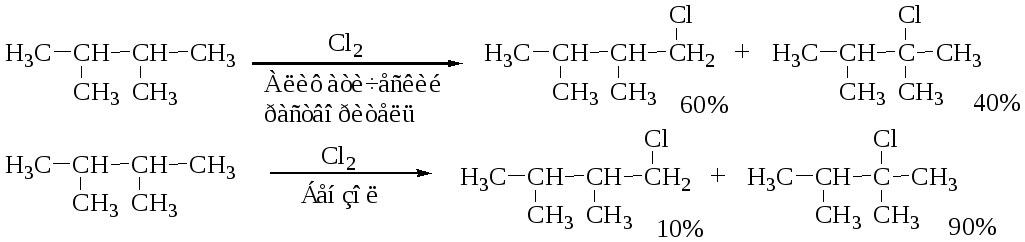
نتایج با اظهارات کمپلکس بین توزیع کننده و اتم کلر توضیح داده می شود.
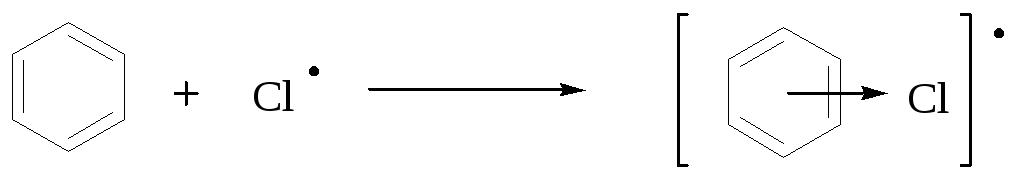
نحوه کاهش کلر واکنشی کمتر و انتخابی تر است.
مکانیسم واکنش - شرح مفصلی از تغییرات در مراحل میانی و گفتار میانی، ماهیت تعامل ذرات واکنشی، ماهیت شکست پیوندها، تغییرات در انرژی سیستم شیمیایی در کل انتقال. Meta vivchennya به مکانیسم واکنش امکان keruvati توسط دوره واکنش، به طور مستقیم و موثر است.
واکنشها را مانند یک مرحله، واکنشهای ساده (ابتدایی) و واکنشهایی را که شامل چند مرحله میشوند، تاخوردگی میگویند.
طبقه بندی واکنش های آلی
اغلب واکنش های آلی بر اساس نوع انتشار صداهای شیمیایی در ذرات طبقه بندی می شوند که واکنش نشان می دهند. علاوه بر آنها، می توانید دو گروه عالی از واکنش ها را ببینید - رادیکال و یک.
واکنشهای رادیکال کل فرآیند عبور از دهانه همولیتیک پیوند کووالانسی است. با توزیع همولیتیک الکترونها، وقتی زنگها را تنظیم میکنم، بهگونهای ادامه مییابد که پوست ذرات، وقتی در حال راهاندازی هستم، هر بار یک الکترون را قطع میکنم. در نتیجه توسعه همولیتیک، رادیکال ها ایجاد می شوند:
X Y → X + Y
اتم خنثی قطعه ای با الکترون جفت نشده رادیکال قوی می گویند.
واکنشهای Ionnі - کل فرآیند گذر از شکست هترولیتیک پیوندهای کووالانسی، اگر توسط پیوند الکترونیکی توهین شود، از یکی از ذرات پیوند دهنده قبلی گم میشود.
XYY → X - + Y +
در نتیجه توسعه هترولیتیک، ذرات باردار وجود دارد: هسته دوست و الکتروفیل.
بخش نوکلئوفیلیک (نوکلئوفیل) - یک زنجیره که در آن چند الکترون در جدیدترین بخش الکترونیکی وجود دارد. برای یک rakhunok pari elektron_v نوکلئوفیل یک پیوند کووالانسی داخلی است.
بخش Elektrofіlna (elektrofіl) - یک بخش کامل که در آن یک مدار بزرگ در جدیدترین واحد الکترونیکی وجود دارد. الکتروفیل نشان دهنده اوربیتال غیرتجدید و خالی برای ایجاد یک پیوند کووالانسی برای واحد الکتریکی این بخش، با پیروزی در حالت است.
از طبقه بندی مشخص است که واکنش های آلی بر پایه حرارتی است، اما نتیجه بازگشت مولکول ها در شرایط حرارتی و فتوشیمی، با چنین مولکول هایی، کوانتوم نور هو است. برای آرام ترین شرایط، واکنش های حرارتی و فتوشیمیایی، اصرار به تولید تا محصولات ریزنیم... لب به لب کلاسیک در اینجا کلرزنی حرارتی و فتوشیمیایی بنزن است - اولی کلروبنزن و دیگری - هگزاکلروسیکلو هگزان.
علاوه بر این، در واکنشهای شیمی آلی اغلب به این صورت طبقهبندی میشود، مانند شیمی معدنی - برای آگاهی ساختاری. در شیمی آلی، تمام تغییرات ساختاری به عنوان یک اتم (یا اتم) در کربن دیده می شود که در واکنش شرکت می کند. برخی از بخش های این نوع کار مجدد:
اتصال R-CH = CH2 + XY → R-CHX -CH2Y
جایگزینی R-CH2X + Y → R-CH2Y + X
افزودن (حذف) R-CHX -CH2Y → R-CH = CH2 + XY
پلیمریزاسیون n CH2 = CH2 → (–CH2 – CH2–) n
علاوه بر هدایت برخی از سادهترین مکانیسمهای واکنش، راکد ماندن از جمله: اکسیداسیون، تجدید، هیدروژنه شدن، تراکم، پیرولیز، پلی تراکم و غیره عملی است.
گزارشهای ارسالی در مورد واکنشهای جایگزینی و هر سه مکانیسم ممکن تحقق درک شده است: رادیکال، هسته دوست و الکتروفیل.
واکنش های جایگزینی هسته دوست
قبل از واکنش های جایگزینی نوکلئوفیل، فرآیندهای جایگزینی هیدروکسیل با هالوژن ها، هالوژن ها - با هیدروکسیل، آلکوکسیل، استوکسی آمینوسالیش ها و کاهش بازها و نمک های آمونیوم انجام می شود. و غیره به عنوان مثال:
C2H5 ׃ Br + OH- → C2H5 ׃ OH + Br-
(CH3) 3N: + CH3: I → [(CH3) 3N: CH3] +: J-:
ارائه دهندگان اینگولد، هیوز، سون و دیگر نظریه پردازان شیمی آلی دو مکانیسم اصلی را برای غلبه بر واکنش های جایگزینی هسته دوست ایجاد کردند: SN1 و SN2.
1. SN1 - مشخصه مکانیسم برای آلکیلو هالوژنیدهای سوم و دو مرحله ای.
مرحله اول شامل تعیین کربوکاتیون در نتیجه تفکیک هترولیتیک اتصال قطبی C-X است:
دوست یک مرحله شویدکا است که شامل افزودن هیدروکسیل آنیون به کربوکاتیون با الکل است.
2. SN2 - مکانیسم مشخصه، به عنوان مثال، متیل کلرید، є یک مرحله ای.
در دنیای نزدیک به معرف - آنیون، یا مولکول ها، برای انتقام گرفتن از یک اتم با یک جفت الکترونیکی استفاده نشده، به یک اتم در کربن، به عنوان مرکز واکنش، برای دیدن اعمال یک گروه که به عنوان جایگزینی برای یک اتم همزمان با یک جفت الکترونیکی.
مکانیسم Ninetyei مکانیسم جایگزینی مستقیم نامیده می شود. در طول واکنش، آنیون Y- می تواند به یک اتم در زغال سنگ نزدیک شود، اگر جایگزین کافی برای برهمکنش فقط از طرف، برخلاف مدافع X وجود داشته باشد.
در طول فرآیند سالم، انرژی کمتری در فرآیند وجود دارد، اگر در مجتمع واکنش، هر 3 اتم (X، Y، C) روی یک خط مستقیم قرار داشته باشند و گروههایی که با یک اتم در کربن گره خوردهاند، در یک خط مستقیم باشند. ، اتم های عمود بر 'yazuє cі. برش بین گروه ها و اتم ها در کربن در منطقه ای تقریبا 120 درجه.
مشاهده بیشتر و بیشتر اتم X با انتقال بیشتر از یون X به یون Y به اتم کربن امکان پذیر می شود تا زمانی که پیوند کووالانسی C-Y ایجاد شود.
شماتیکی از فرآیند را می توان در viglyad پرداخت کرد:
در نتیجه جایگزینی این نوع، مشخص می شود که پیکربندی در نتیجه ظاهر نمی شود. به مدت یک ساعت، فرآیند جایگزینی آن با رفتار "ویورتینگ" یک مولکول شبیه چتر آفتابی با پیچش قوی است.
واکنش های جایگزینی الکتریکی
قبل از واکنشهای جایگزینی الکتروفیزیکی، انجام آن فرآیندها ضروری است، زمانی که معرف واکنشی به مولکول واکنشدهنده میآید، به الکترونیک پیوند کووالانسی جدیدی نمیدهد تا برقرار شود. مولکولهای دروغگو باقی میمانند که واکنش نشان میدهند، علاوه بر جدا شدن یک اتم، یا گروهی از اتمها بدون شرطبندی الکترونیکی ظاهر میشوند.
زوویچای واکنش جانشینی الکتروفیل در مقابل انتهای انرژی عوامل الکتروفیل است. قبل از واکنشهایی از این نوع در سری آروماتیک، فرآیندهای جایگزینی الکتروفیزیکی آب معرفی شدهاند: واکنشهای اختلال و سولفوناسیون، واکنش فریدل کرافت، هالوژناسیون و مسافرخانه. دلایل آنچه در زیر مشاهده خواهد شد.
مکانیسم جایگزینی الکتروفیل در هسته آروماتیک به وضوح قابل مشاهده است. برای کسانی که به دنبال مهم ترین واکنش ها هستند، مهم نیست، آنها حتی در پشت مکانیسم بوی بد شبیه تر هستند. در همه موارد، جایگزینی یک اتم با یک گروه دارای بار مثبت دیده می شود و افراد دیگر می توانند آن را توصیف کنند:
اغلب اتم با آب جایگزین می شود و از جایگزینی سایر مازادهای تک ظرفیتی محافظت می کند.
در واکنشهای SE، حلقه بنزن توسط یک الکتروفیل مورد حمله قرار میگیرد که میتواند یک کاتیون (R +، NO2 + و in) یا یک مولکول خنثی و پلاریزه آل (SO3 نازک است). مانند مادران در ذهن شما، او معمولاً در مقابل واکنش های خود یک عامل حمله الکتروفیلیک است. به طور شماتیک، جایگزینی الکتروفیلیک را می توان در viglyad پرداخت کرد:
مکانیسم شامل 2 مرحله است. در مرحله اول یک مجتمع π ایجاد می شود که در آن سیستم π-الکترونیک عرصه ای است که اهداکننده الکترونیک است و یک عامل الکتروفیلیک پذیرنده است. در عین حال، عامل الکتروفیلیک سیستم π الکترونیکی هسته معطر را از بین نمی برد. π یک پیچیده است، اگر می توانید مقدار انرژی را تغییر دهید، می توانید نوار فعال سازی را اضافه کنید و به یک قطعه جدید تبدیل کنید و یک حلقه جدید С-Е را تنظیم کنید. به چنین قسمتی کمپلکس σ می گویند. Elektrofіl خواهد آمد به rakhunok شرط electronіv kіltsya. کمپلکس σ هیچ ساختار آروماتیکی ندارد. لازم است بدانید که مرحله ایجاد کمپلکس σ رایج ترین واکنش و دلیل سرعت واکنش جانشینی الکتروفیل است. نوسانات در کمپلکس σ هدایت می شوند؛ سیستم π-الکترونیکی پایدار است، اما ناپایدار است. کمپلکس σ به یک سیستم پایدار معطر به شکل E + یا H + تبدیل می شود. اغلب جایگزین کردن پروتون و جایگزینی بنزن آسان تر است. به عنوان یک محصول میانی، امکان ایجاد یک کمپلکس π وجود دارد که در آن یک ذره الکتروفیل یک پروتون است.
واکنش جایگزینی رادیکال
تئوری واکنشهای رادیکال ظالمانه لانتسیوگووی که توسط دکترین روسی ایجاد شد، برنده جایزه جایزه نوبل N.N.Semenov.
واکنش های جایگزینی رادیکال برای آلکان ها بسیار مشخص است. Tse z high mіtsnіstyu σ - zv'yv N-W і C-H، و yak і їх غیر قطبی. پیوندهای غیر قطبی C-C و C-H در آلکان ها تا زمانی که شکسته نشوند قوی نیستند، اما به طور همولیتیک از سایر رادیکال ها جدا می شوند. کلید کلاسیک جایگزینی رادیکال برای تعدادی از آلکان ها، واکنش کلرزنی به متان است. مکانیسم سخنرانی به راحتی قابل درک است.
مکانیسم جایگزینی رادیکال (کلروفرمینگ):
1.Inіtsіyuvannya lantsyuga (hν - UV-vipromіuvannya)
Cl – Cl → Cl + Cl
2. Zrostannya lantsyuga
Cl + CH3 - H → HCl + CH3
CH3 + Cl2 → Cl + CH3Cl و غیره
3. اصلاح lantsyuga
CH3 + Cl → CH3Cl
CH3 + CH3 → CH3 - CH3
لغزش به این معنی است که از برهمکنش آلکان ها با هالوژن ها، مجموع محصولات از آلکان های تک تا چند هالوژنه به دست می آید.
بخش عملی
"واکنش های قبلی نفوذ و هالوژناسیون"
متا: سنتز متا دی نیتروبنزن، ایزوپروپیل بروماید را انجام می دهد.
از لحاظ نظری obruntuvannya.
واکنش nontruvannya
نیمه گروه آلی با گروه نیترو (-NO2) را گروه نیترو و ورود گروه (-NO2) به مولکول آلی واکنش گروه نیترو نامیده می شود.
گروه نیترو باید به دو ساختار تشدید شدید در نما نگاه کند:
ساختار واقعی نیتروگروپ باید به صورت زیر ارائه شود:
دارا بودن nitrospoluk آلیفاتیک.
با استفاده از روش مایر (متولد 1976) با استفاده از نمونه ای از هالوژن آلکیل های مستعد واکنش با نیتریت محیط، گروه -NO2- را به کربوهیدرات مرزی در آزمایشگاه وارد کنید:
C2H5I + AgNO2 → C2H5NO2 + AgI
ترتیب نیمهای نیترو به عنوان محصول جانبی اسید نیتروژن اتری (RON = O) تنظیم میشود. فرآیند در مرحله اول را می توان به عنوان واکنش یک نیروی الکتروفیل که از طریق فرآیند یک محلول یکپارچه می گذرد ارائه کرد:
نسخه فعلی دارای اثر باطل NaNO2، KNO2 است و قدرت حلپذیری بالایی دارد.
Nitruvannya در کربوهیدرات ها به گفته Konovalov (متولد 1888) در آن هنگام که کربوهیدرات ها در دمای 115-120 درجه سانتیگراد با اسید نیتریک رقیق شده (10-20٪) گرم می شوند. در همان زمان، جایگزینی اتم با یک آلکان آب برای گروه -NO2 - در نظر گرفته می شود.
(CH3) 3CH + HONO2 → (CH3) 3CNO2 + H2O
به نوعی جایگزینی گروه -NO2 - در اتم سوم کربن و مهمتر از آن در اتم دوم آسان است و امکان جایگزینی برای اتم اول وجود ندارد. مکانیسم واکنش ها رادیکال است.
از دیدگاه بیوقفه، از روش خنثیسازی فاز بخار آلکانهای پایینتر استفاده میشود - گونهای از روش Konovalov. خنثی سازی در کربوهیدرات اسید نیتریک در دمای 400-420 درجه سانتیگراد. این روش اجازه می دهد تا otrimuvati از ترتین، دوم، اما اول nitropoluki محروم نیست.
در ذهن واکنش، ترک خوردگی در کربوهیدرات ها وجود دارد، بنابراین محصولات این واکنش در پایین ترین قسمت ورزش های نیتروسورت هستند. ناتروسپولوک های منفرد توده های ارتجاعی از راه اصلاح دیده می شوند.
مکانیسم جایگزینی رادیکال (nіtruvannya):
1.Inіtsіyuvannya lantsyuga
HO-NO2 → HO + NO2
2. Zrostannya lantsyuga
HO + RH → H2O + R
R + HO-NO2 → HO + RNO2
3. اصلاح lantsyuga
R + NO2 → RNO2
R + HO → ROH
نیتروسپولوک معطر Otrimannya.
نیتروسفورز معطر واکنش های جایگزینی الکتریکی را تشخیص می دهد. سنتز با گرم کردن یک هیدروکربن معطر از مجموع غیر استریل (مجموع غلظت اسیدهای HNO3 و H2SO4 به نسبت 1: 2) انجام می شود.
عامل الکتروفیل در واکنش NO2 + کاتیون است.
فرآیند نفوذ به هسته آروماتیک بر اساس طرح ورودی جایگزینی الکتروفیل است.
فرآیند کاهش مقدار انرژی مورد نیاز را می توان حتی بیشتر انجام داد، یا برای معرفی یک گروه نیترو دیگر، مقدار آب مورد نیاز (دمای 75-80 درجه سانتیگراد، اسید غلیظ است).
نیتروگروه سوم از همه مهمتر معرفی شده است، پنج برابر بیش از حد اسید نیتریک دینیک مورد نیاز است و گرمایش تا 110 درجه سانتیگراد با کشش چند دیب مورد نیاز است. با طیف گسترده ای از تری نیتروبنزن، کمتر از 45٪ می شود.
همولوگ های بنزن راحت تر جذب می شوند. بنابراین، زمانی که تولوئن بی اهمیت نیست، وقتی من با خروجی بالا مخلوط می شوم، از تری نیتروتولوئن استفاده می کنم.
واکنش هالوژناسیون
آلکیل هالیدها اغلب برای چنین واکنش هایی شناخته می شوند:
جایگزینی رادیکال برای آلکان ها.
تامین برق به آلکن؛
جایگزینی گروه OH در الکل ها به جای هالوژن.
جایگزینی رادیکال در بین آلکان ها
تماس با vikoristovuyutsya برای حذف کلر برم حاوی کربوهیدرات. به همین دلیل است که برهمکنش فلوئور با آلکان ها از دید انرژی عبور می کند که انرژی توسعه پیوندهای C - C و C - H را به محصولات واکنش زنجیره ای - HF و CF4 تغییر می دهد. گرماده بودن واکنش آلکانهای یددار به دزدی ویسوکا و باد کردن در دمای 300 درجه سانتیگراد عملاً ناراحت کننده است.
خانه ریونیانیا:
CH4 + Cl2 → CH3Cl + HCl
این بدان معناست که جانشینی در اتم دوم آسان تر است، در اتم سوم کربن راحت تر است، به طوری که پایداری رادیکال شروع می شود که در مرحله صنعتی پذیرفته شده است.
تامین برق به آلکن.
از ذهن ذهنم بگذرم و توسط تایید محصولات جانبی هدایت نشم:
CH2 = CH2 + HCl → CH3 - CH2 - Cl
انتقال الکتروفیل (پروتون) به آلکن:
انتقال نوکلئوفیل (Cl-) به کربوکاتیون:
برای یک آلکن نامتقارن:
برای اثر القایی مثبت پیوندهای CH3 - گروه π - - با یک اتم هیدراته بزرگ در کربن جایگزین میشوند.
پذیرش خلاف قانون مارکوفنیکف در دو مورد ممکن است نادیده گرفته شود:
1. و همچنین در مولکول های آلکن - یک جایگزین گیرنده الکترونیکی
2. که در یک مکانیسم رادیکال درگیر است
CH3 - CH = CH2 + HBr → CH3 - CH2 - CH2 (Br)
(کاتالیزور - پراکسید آلی ROOR) الف). lantsyuga іnіtsіyuvannya:
RO-OR → 2RO b). zrostannya lantsyuga:
RO + HBr → ROH + Br
CH3 - CH = CH2 + Br → 1). CH3 - CH2 - CH2 (Br) (رادیکال پایدارتر)
2). CH3 - CH (Br) - CH2
CH3 - CH2 - CH2 (Br) + HBr → Br + CH3 - CH2 - CH2 (Br) c). لانتسیوگا اصلاح:
CH3 - CH2 - CH2 (Br) + Br → + CH3 - CH2 (Br) - CH2 (Br)
جایگزینی گروه های هیدروکسیل در الکل ها به جای هالوژن.
دیا هیدروژن هالید - واکنش معکوس:
ROH + HCl ↔ R-Cl + H-OH
برای جایگزینی رینوواژی، یا یکی از معرفها را از مازاد برداشت کنید یا به تدریج یکی از محصولات حاصل از مجموع واکنش را ببینید. الکل های ثالثی وارد یک واکنش بسیار آسان تر، کمتر دوم و اول می شوند. ارزش آن را دارد که به یک سبک بزرگتر از کاتیون توضیح دهید، که چگونه یک بیانیه را بیان کنید.
واکنش باید به گونه ای انجام شود که هالید هیدروژن بدون پیشینی در محیط واکنش ایجاد شود (مثلاً وقتی الکل از KBr و H2SO4 گرم می شود).
C2H5OH + KBr + H2SO4 → C2H5Br + H2O + KHSO4
در پایان واکنش، واکنش با آب خلاصه می شود که به شما کمک می کند تا در صورت تبخیر HBr از شر مجموع خلاص شوید.
زمانی که ید و برم در حضور فسفر شبیه هالوژن باشند را می توان با الکل ها برش داد:
6ROH + 2P + 3Hal2 → 6RHal + 2P (OH) 3
جایگزینی الکتروفیل در محدوده معطر.
ترکیب هالوژن معطر برای تشخیص واکنش جایگزینی الکتروفیل در محدوده آروماتیک:
C6H6 + Br2 → C6H5Br + HBr
واکنش قبل از هالوژن روی بنزن در حضور یک کاتالیزور - اسید لوئیس (AlCl3، AlBr3، FeCl3 نیز) انجام می شود. cy spoluces є اسیدهای آپروتیک. Є پذیرنده های الکترون برای اتم فلز، جایی که اوربیتال خالی است.
آ). آموزش کارگزار برق
Br - Br + AlBr3 ↔ ↔ Br + + (Br - AlBr3) - b). تعامل الکتروفیل با هسته
H + + AlBr4- ↔ → AlBr3 + HBr
در مولکول های همولوگ به بنزن، هالوژن می تواند توسط یک هسته معطر و مقدار زیادی lantsyug مورد حمله قرار گیرد. مستقیماً حمله کنید تا ذهن واکنش نشان داده شود.
تکنیک بازدید رباتیک:
سنتز متا دی نیتروبنزن.
معرف ها:
نیتروبنزن 0.5 گرم
HNO3 (conc) 2ml
H2SO4 (conc) 1ml
2 میلی لیتر H2SO4 (مغلط) را در یک لوله آزمایش پهن، سپس 1 میلی لیتر اسید نیتریک، کم نور بریزید. 0.5 گرم نیتروبنزن را به صورت مرحله به مرحله با استفاده مکرر به مقدار نیتروبنزن اضافه کنید. لوله را با چوب پنبه ای که یک لوله فلاسک کوتاه (20-25 سانتی متر) داخل آن قرار داده اید ببندید و آن را به مدت 30 دقیقه در یک حمام آب جوش گرم کنید که یکی از آنها به جای لوله از نظر انرژی خرد می شود.
برای تکمیل واکنش، نمونه را شل کنید: هنگامی که به لوله آزمایش اضافه می شود، آب سردلکه دسیلکوه جنون ارتجاعی (برای یک چوب پوسته پوسته اضافی) گناهی ندارد که به اولیا، توبتو نیتروبنزن افتاده است، اما واکنشی نشان نداده است. حباب ها به دلیل گیر افتادن در کریستال های دیتروبنزن مقصر هستند. برای شواهد موجود در نمونه، حرارت دادن باید 10-15 دقیقه ادامه یابد و مجدداً نمونه برداری شود.
یک مرتجع سرد با یک چوب پرتاب کننده در یک فلاسک آب سرد خلاصه می شود و سپس بیرون می زند.
دی نیتروبنزن که متبلور می شود در یک فیلتر با آب شسته می شود تا زمانی که واکنش اسیدی منفی شود. Vidzhimayut و کریستال ها را آویزان کنید.
تقلب در راه رسیدن به کالا.
روزراهونوک ویخدو:
مقدار نیتروبنزن گرفته شده برای واکنش:
ν (C6H5NO2) = 0.5/123 = 0. 0041 مول از همان، از لحاظ نظری ν (C6H4 (NO2) 2) = 0.0041 مول، جرم یاک m (C6H4 (NO2) 2) = 0.041 × 168 = 0.683 گرم ...
جرم عملی به دینیتروبنزن 0.2 گرم و همچنین از موارد زیر ذخیره شد:
سنتز ایزوپروپیل بروماید
معرف ها:
(CH3) 2CH – OH 20ml cis 30g
در یک فلاسک 300 میلی لیتری ته گرد، 20 میلی لیتر H2SO4 بریزید و به سرعت با مخلوط کردن مداوم، 20 میلی لیتر الکل ایزوپروپیل را که در جای فلاسک با جت خنک شده است، اضافه کنید. آب سرد... تا زمانی که خنک شود دمای اتاقدیوانه، خنک کننده و مخلوط کردن را فشار ندهید، 30 گرم سودا اضافه کنید، دوباره گل رز را به دمای اتاق خنک کنید و 30 گرم KBr تنظیم شده را به فلاسک اضافه کنید.
فلاسک را با یک فلاسک واکنش به یخچال مستقیم پشت یک لوله فلاسک بسته اضافی فشار دهید. Kinchik alonzhu zanureyuyut آب سرد یخ، به قطره ایزوپروپیل برمید ریخته می شود. خود پریماچ را می توان با کمک یک محصول بخارپز در طی فرآیند روباتیک در یک فنجان آب قرار داد.
فلاسک از یک گرمایش مجلل روی یک حمام چرخشی گرم می شود، که از تشکیل برومید ایزوپروپیل جلوگیری می کند و از چشم لکه های روغنی مهم قبل از آب در ورودی می ریزد.
در صورتی که قطرات ایزوپروپیل بروماید به سمت ورودی آب نریزد، واکنش به پایان می رسد و گرما سفت می شود (یک توپ بدون بار از ایزوپروپیل گرفته می شود)
Vidokremlyuyut (CH3) 2CH - Br از آب از dililny lіtsі خشک با کلرید کلسیم بی آب.
واکنش های Rozrahoyuyt vikhіd.
روزراهونوک ویخدو:
Vrahoyuchi، اما ρ ((CH3) 2CH - OH) = 0.78 گرم در میلی لیتر،
ν ((CH3) 2CH – OH) = (20 · 0.78) / 60 = 0.26 مول؛
ν (KBr) = 30/119 = 0.25 مول، در حالی که از نظر تئوری m ((CH3) 2CH-Br) = 0.225123 = 31.0 گرم، در شرایط عملی، محصول 10.6 گرم بسته بندی شد. ، و از همین صفحه:
ویسنووک
خبرهای خوشحال کننده در مورد مکانیک واکنش های شیمیاییبول ها بر اساس مواد تجربی غنی از شیمی و هدایت فرآیندهای شیمیایی ساخته شدند.
هیچ مکانیسم هوشمندی برای جلوگیری از واکنش های شیمیایی وجود ندارد. هوشمندانه ترین روز به شما این توانایی را می دهد که شیمی آلی نظری را برای اهداف عملی به طور کارآمد مقیاس کنید، فرآیندهای شیمیایی را به طور کامل مدیریت کنید، که در صنعت به شما امکان می دهد مقیاس انبار را در یک ساعت تنظیم کنید.
1. طبقه بندی مکانیسم های واکنش های شیمیایی را از نگاهی به نظریه الکترونیکی انجام داد.
2. سه نوع مکانیسم واکنش های جایگزینی در سری های آلیفاتیک و معطر در نظر گرفته می شود: جایگزینی الکتروفیل، هسته دوست و رادیکال.
3. سنتز متا دی نیتروبنزن و ایزوپروپیل برومید، بیمه انواع واکنش ها، شرح مکانیسم های آنها ایجاد شده است.
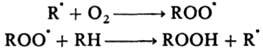
واکنش های رادیکال، Zd_ysnyuyutsya برای مشارکت مرکز رادیکال viln. رادیکال ها
به عنوان یک قاعده، با ارزش های بزرگ بازنمایی مشخص می شود. ضریب در ur-ny Arrenius و malmi energiyami فعال سازی ه.شامل دو مرحله پذیرفته شده - پوشش پروژه. رادیکال ها و خم شدن آنها Osvita رایگان رادیکال ها در قالب شیمی در نظر گرفته می شوند. zvyazyka، که برای هر دو قطعه یک جفت نشده وجود ندارد. مثلا:
واکنش بین رادیکال های قوی Zd_ysnyuitsya هنگامی که به هم متصل است. دو تا از همون decomp abo. رادیکال های بیانیه های شیمی جدید. پیوند (بازترکیب). P-tsya zzvychay کنترل انتشار; Eاز 0 تا 5 کیلوژول در مول. Vidbuvatsya، به عنوان مثال، با org dehydrodimerization. z'єdnan قبل از diєyu پراکسید abo in. مثلا:
% D0% A0% D0% B0% D0% B4% D0% B8% D0% BA% D0% B0% D0% BB% D1% 8C% D0% BD% D1% 8B% D0% B5% 20% D1% 80 % D0% B5% D0% B0% D0% BA% D1% 86% D0% B8% D0% B8,% 20% D0% BE% D1% 81% D1% 83% D1% 89% D0% B5% D1% 81% D1% 82% D0% B2% D0% BB% D1% 8F% D1% 8E% D1% 82% D1% 81% D1% 8F% 20% D1% 81% 20% D1% 83% D1% 87% D0% B0% D1% 81% D1% 82% D0% B8% D0% B5% D0% BC% 20% D1% 80% D0% B0% D0% B4% D0% B8% D0% BA% D0% B0% D0% BB% D1% 8C% D0% BD% D0% BE% D0% B3% D0% BE% 20% D1% 86% D0% B5% D0% BD% D1% 82% D1% 80% D0% B0% 20% D1% 81% D0% B2% D0% BE% D0% B1.% 20% D1% 80 % D0% B0% D0% B4% D0% B8% D0% BA% D0% B0% D0% BB% D0% BE% D0% B2.
% D0% A5% D0% B0% D1% 80% D0% B0% D0% BA% D1% 82% D0% B5% D1% 80% D0% B8% D0% B7% D1% 83% D1% 8E% D1 % 82% D1% 81% D1% 8F,% 20% D0% BA% D0% B0% D0% BA% 20% D0% BF% D1% 80% D0% B0% D0% D0% B2% D0% B8% D0% BB% D0% BE,% 20% D0% B1% D0% BE% D0% BB% D1% 8C% D1% 88% D0% B8% D0% BC% D0% B8% 20% D0% B7% D0% BD % D0% B0% D1% 87% D0% B5% D0% BD% D0% B8% D1% 8F% D0% BC% D0% B8% 20% D0% BF% D1% 80% D0% B5% D0% B4 % D1% 8D% D0% BA% D1% 81% D0% BF% D0% BE% D0% BD% D0% B5% D0% BD% D1% 86.% 20% D0% BC% D0% BD% D0% BE% D0% B6% D0% B8% D1% 82% D0% B5% D0% BB% D1% 8F% 20% D0% B2% 20% D1% 83% D1% 80% D0% B0% D0% B2% D0% BD% D0% B5% D0% BD% D0% B8% D0% B8% 20% D0% 90% D1% 80% D1% 80% D0% B5% D0% BD% D0% B8% D1% 83% D1% 81% D0% B0% 20% D0% B8% 20% D0% BC% D0% B0% D0% BB% D1% 8B% D0% BC% D0% B8% 20% D1% 8D% D0% BD% D0% B5% D1% 80% D0% B3% D0% B8% D1% 8F% D0% BC% D0% B8% 20% D0% B0% D0% BA% D1% 82% D0% B8% D0% B2% D0% B0% D1% 86% D0% B8% D0% B8% 20 % D0% 95.% 20% D0% 92% D0% BA% D0% BB% D1% 8E% D1% 87% D0% B0% D1% 8E% D1% 82% 20% D0% BF% D0% BE% 20% D0% BA% D1 % 80% D0% B0% D0% B9% D0% BD% D0% B5% D0% B9% 20% D0% BC% D0% B5% D1% 80% D0% B5% 20% D0% B4% D0% B2 % D0% B5% 20% D1% 81% D1% 82% D0% B0% D0% B4% D0% B8% D0% B8% 20-% 20% D0% BE% D0% B1% D1% 80% D0% B0% D0% B7% D0% BE% D0% B2% D0% B0% D0% BD% D0% B8% D0% B5% 20% D1% 81% D0% B2% D0% BE% D0% B1.% 20 % D1% 80% D0% B0% D0% B4% D0% B8% D0% BA% D0% B0% D0% BB% D0% BE% D0% B2% 20% D0% B8% 20% D0% B8% D1 % 85% 20% D0% B3% D0% B8% D0% B1% D0% B5% D0% BB% D1% 8C.% 20% D0% 9E% D0% B1% D1% 80% D0% B0% D0% B7% D0% BE% D0% B2% D0% B0% D0% BD% D0% B8% D0% B5% 20% D1% 81% D0% B2% D0% BE% D0% B1.% 20% D1% 80 % D0% B0% D0% B4% D0% B8% D0% BA% D0% B0% D0% BB% D0% BE% D0% B2% 20% D0% BF% D1% 80% D0% BE% D0% B8 % D1% 81% D1% 85% D0% BE% D0% B4% D0% B8% D1% 82% 20% D0% B2% D1% 81% D0% BB% D0% B5% D0% B4% D1% 81 % D1% 82% D0% B2% D0% B8% D0% B5% 20% D1% 80% D0% B0% D0% B7% D1% 80% D1% 8B% D0% B2% D0% B0% 20% D1 % 85% D0% B8% D0% BC.% 20% D1% 81% D0% B2% D1% 8F% D0% B7% D0% B8,% 20% D0% BF% D1% 80% D0% B8% 20 % D0% BA% D0% BE% D1% 82% D0% BE% D1% 80% D0% BE% D0% BC% 20% D0% BD% D0% B0% 20% D0% BE% D0% B1% D0 % BE% D0% B8% D1% 85% 20% D1% 84% D1% 80% D0% B0% D0% B3% D0% BC% D0% B5% D0% BD% D1% 82% D0% B0% D1 هشت درصد 5% 20 مولکول ها یا یکی از آنها یکی جفت نشده را از دست خواهد داد. مثلا:
واکنش کیا m. B. به هر دلیلی به هشدارها، بهینه سازی ها القا شده است.
رادیکال ها ممکن است تجزیه شوند. واکنش. می توان از طبیعت، نوع واکنش ها، قطبی و فضایی دراز کشید. فاکتور_در اثر توزیع کننده.
واکنش بین رادیکال های قوی Zd_ysnyuitsya هنگامی که به هم متصل است. دو تا از همون decomp abo. رادیکال های بیانیه های شیمی جدید. پیوند (بازترکیب). واکنش با انتشار کنترل می شود. Eاز 0 تا 5 کیلوژول در مول. Vidbuvatsya، به عنوان مثال، با org dehydrodimerization. spoluk pіd dієyu peroxidіv abo in. مثلا:
واکنش های کلبی):
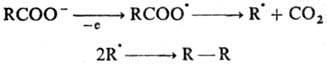
نوترکیبی در فرآیند کاتدی را می توان برای الکتروشیمی در نظر گرفت. ... به عنوان مثال، ترکیبات کربونیل:
اثر کلیتینی).
عدم تناسب-
به عنوان یک قاعده، فرآیند اصلی نوترکیب نیست. واکنشهای توهینآمیز گرمازا هستند و به راحتی نمیتوان یک ساعت طول کشید.
واکنش های لانتسیوگوف). E
E
اس آر 2.
![]()
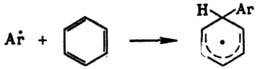
واکنش های جایگزینی رادیکال در آروماتیک هسته ها نیزه ای نمی شوند و مرحله ایجاد رادیکال های سیکلوهگزادینیل را طی می کنند:
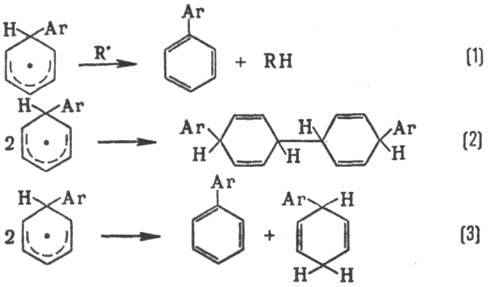
ورود مجدد به یک محصول رنگی در نتیجه انتشار H برگردانده می شود (واکنش 1). فرآیندهای نوترکیبی جانبی (2) و عدم تناسب (3):
متر،і nایزومری با خمیرهای مجدد O-ایزومر
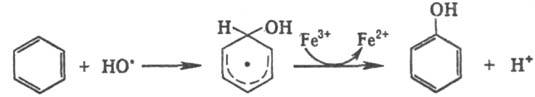
رادیکال های هیدروکسیل که توسط معرف فنتون (H2O2 + Fe2 +) تولید می شوند، معمولاً غیر فعال هستند. معطر هسته. در همان زمان، یک رادیکال وانمود می کند که در حضور Fe 3+ دیمر می شود. برای فنل:
پیوند Vіlnoradicalnaya فرآیند C = C-lanceyugovy با سینتیک کوتاه. لانتسیوگامی پراکسیدها، انتقال و تشخیص UV را معرفی کنید. واکنش استری انتخابی نیست. استریو انتخابی بالا ( ترنس-پذیرش) برای. E
Vіlnoradikalnja اتصال С = З به طور گسترده در سنتز آلی استفاده می شود، از جمله. در بی بند و باری
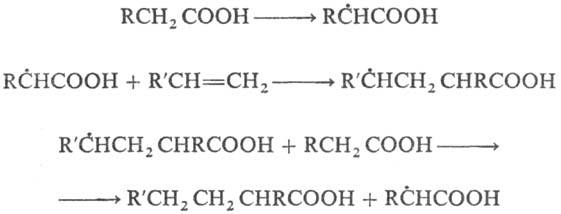
قبل از واکنش های یک اعتراف کاملاً رادیکال، نیز چنین است تلومریزاسیون -واکنش lantsyugov غیر شرور z'єдн. در حضور rechovins (تلوژن)، که در نتیجه آن مجموع مولر کم وجود دارد. همولوگ ها (تلومرها). این واکنش در حذف تتراکلروآلکان های a، a، a، w از CC1 4 و اتیلن و اسیدهای کربوکسیلیک گالوانیزه از اسید پروپیونیک و اتیلن بد است، به عنوان مثال:
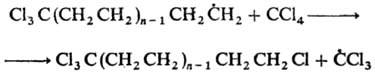
در پشت یک مکانیسم مشابه، یک افراط گرایی رادیکال بدون خشونت وجود دارد.
واکنش های درون مولکولی رادیکال های قویتکه تکه شدن را می توان به یک نوع واکنش در نظر گرفت - تجزیه یک رادیکال به یک مولکول و یک رادیکال با یک مول کوچک. ماسویو. واکنش توسط بسیاری جذب می شود. رادیکال های β-هالوژن، β-تیو، a-هیدروکسی آلکیل، و همچنین برای آلکوکسیل، آسیلوکسی و سایر رادیکال ها. همچنین تکه تکه شدن را می توان روی عرشه ها انجام داد. به طور مستقیم (به عنوان مثال، با الکل های سوم نامتقارن اکسید شده)، درک آن بسیار مهم است. آنهایی که می توانند به یک رادیکال پایدارتر منجر شوند، برای مثال:
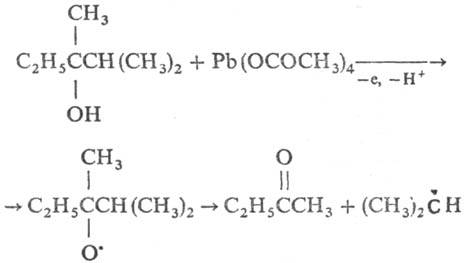
زیرا در واکنش های کل نوع همولیز، یک زنگ وجود دارد، حلقه در موقعیت β با توجه به رابطه با جفت نشده تکان می خورد. پس چنین فرآیندی یکی از ستاره ها است. تقسیم بتا یا تقسیم بتا. رادیکال های آسیل که از آلدهید تولید می شوند، به راحتی در دمای 100 درجه سانتیگراد به رادیکال های قلیایی و CO تقسیم می شوند.
تکه تکه شدن رادیکالهای سیکلوآلکوکسی، که از سیکلوآلکانولها یا سیکلوآلکانونها به وجود میآیند، در سنتز آلیفاتیک ایجاد میشوند. دو منظوره z'єdnan برای این طرح:
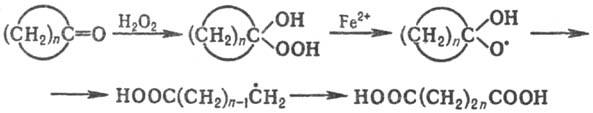
تکه تکه شدن رادیکال های قلیایی، که در طول زمان رخ می دهد، در فرآیند دفع نفتا در کربوهیدرات ها یافت می شود.
رادیکال ها می توانند مجذوب گروه بندی مجدد از مهاجرت اتم ها و (یا) توابع شوند. گروه در عین حال، ایجاد یک رادیکال باثبات نیز انتظار نمی رود. رادیکال های آلکیل، آلکوکسیل، آمینیل، آمیدیل با 1.5 میلی گرم H از C تا مرکز رادیکال مشخص می شوند. برای مثال، واکنش مرحله کلیدی در آلکانول های اکسید شده در تتراهیدروفورانیوم، اسیدهای کربوکسیلیک در g-لاکتون، متیل آلکیل کتون ها در g-دیکتونیوم است:
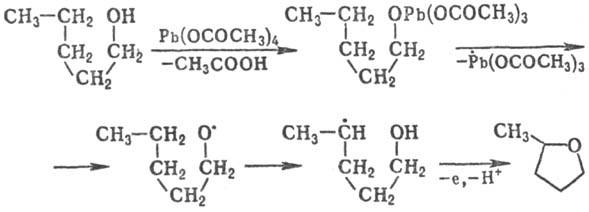
در برخی موارد، ترتیب 1.5- و 1.6- مهاجرت اتم های H ترویج می شود، به معنی مهاجرت بیشتر-1.3- و 1.4-.
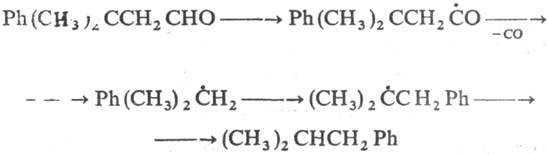
به واکنشهای رادیکالهای مرکز C با 1،4 مگاسکل آریل یا گروههای CN، 1،2 مگاتوم کلر، Br یا گروههای آریل، استوکسیل، آسیل و وینیل نگاه کنید، برای مثال:
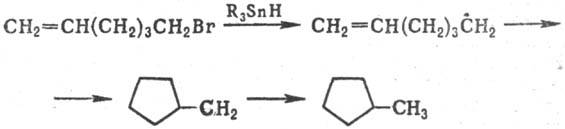
ویدومو همچنین مول داخلی. اتصال به رادیکال های بدبین کربن-آپو که در مرکز صداهای متعدد یا معطر قرار دارند. هسته. به این ترتیب تظاهر به چرخه های 5 و 6 عضوی آسان است، به عنوان مثال:
اکسیداسیون و تجدید رادیکال های قوی.نایب توسط اکسیداسیون تک الکترونی رادیکال های C-center با نمک های Cy (II)، Co (III)، منگنز (III)، Fe (III)، سرب (IV)، Ce (IV). واکنش به کیفیت بالای لیگاند منتقل شده (C1، Br، CN و іn.)، به عنوان مثال:
هنگامی که با استات یا سولفات Cy (II) اکسید می شود، واکنش تحت نظارت قرار می گیرد تا پروتونه شود، تا یک پیوند فرعی تا انتها ایجاد شود. واکنش vikoristovutsya در سنتز غیر شرور z'єдн. از تابع در گروه ها به عنوان مثال:
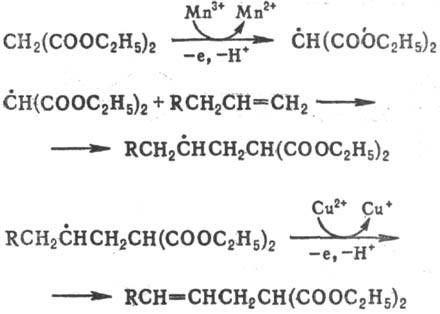
یک واکنش معمولی به روز رسانی رادیکال های فنوکسیل و نیترو-گزیل، به عنوان مثال:
![]()
معرفی مکانیسم انتقال رادیکال های الکترون C محور از جایگزین های گیرنده الکترون در مرکز رادیکال بسیار آسان است، به عنوان مثال:
![]()
بخش همچنین رادیکال ها عالی هستند.
روشن: Nonhibel D., Walton J., Chemical Radicals, Prov. z English, M., 1977; Rozantsev E.G., Scholle St D., Organic Chemistry of strong radicals, M., 1979; دیویس دی.، پرت ام.، رادیکال های ویلنی در سنتز آلی، prov. s English, M., 1980; Nonhibel D.، Tedder J.، Walton J.، Radicali، Prov. s English, M., 1982; رادیکال های آزاد، ویرایش. توسط J.K. کوچی، v. 1-4، N.Y. 1973-80; گزینش پذیری و کاربردهای مصنوعی واکنش های رادیکال. سمپوزیوم چهاروجهی در چاپ، "چهاروجهی"، 1985، ج. 41 # 19; Giese St, رادیکال در سنتز آلی. تشکیل پیوندهای کربنی، Oxf. 1986; Curran D.P. "Synthesis"، 1988 شماره 6، ص. 417-39; همان، 1988، شماره 7، ص. 489-513.
G. I. نیکیشین.
32-59.jpg "align =" absmiddle ">
دکتر. باسن viln. رادیکال ها - الکتروشیمی. سنتز آندی (بخش واکنش های کلبی):
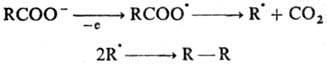
نوترکیبی در فرآیند کاتد را می توان با مدارهای الکتریکی انجام داد. ... به عنوان مثال، ترکیبات کربونیل:
با نزدیک roztashuvannі دو vіln. رادیکال های موجود در "مشتری" توزیع کننده (به عنوان مثال، که در صورت یخ زدگی حرارتی پراکسیدها یا دیازادنان ایجاد می شوند)، واکنش گزینش پذیری بالایی دارد (تقسیم. اثر کلیتینی).
با الهام از تأثیر تغییر ناشی از کاهش دما و کاهش اندازه توزیع کننده.
زمانی که قابلیت همکاری دارد. دو رادیکال نیز می تواند باشد عدم تناسب-zionuvannya-انتقال H (اتم هالوژن) از یک رادیکال به رادیکال دیگر، به عنوان مثال:
واکنش های رادیکال های قوی از مولکول ها. ویژگیهای فرآیندهای عملا مهم، یاک. ... سولفوکلرووانیس،. که در پشت مکانیزم نوع لنس (بخش. واکنش های لانتسیوگوف).Їx برای دسامبر مرتبه پایین تر، مرتبه پایین تر برای نوترکیب. E= 20-60 کیلوژول در مول. بنابراین، واکنش اتواکسیداسیون در نتیجه واکنشهایی که به صورت باگاتوراز تکرار میشوند، به شرح زیر رخ میدهد:

تراشیده lantsyuga vidbuvaєatsya مسیر abo از ROO. برای آبکاری خودکار اکسید می شود. فرآیندهای vicoristovuyut. جادار و سخت یا معطر شود. ... رادیکالها همراه با محرکها، فنوکسیلهای غیرفعال و رادیکالهای آمینیل را تشکیل میدهند که در مراحل رشد لانسیوگا شرکت میکنند. مکانیزم، مشابه آنچه که توضیح داده شد، قدرت ویتامین ها را خلاصه می کند. Eدر روز 2 روی سلولی از موجودات زنده.
مکانیسم واکنش جایگزینی رادیکال گروه های قلیایی، تییل، آسیلوکسیل، آلکوکسیل و سایر گروه ها، از جمله آزاد شدن پیوند از یک مولکول رادیکال، و ایجاد یک پیوند جدید برای مشارکت یک رادیکال، به عنوان مثال:
برای آنالوژیєyu z نوکلئوف. واکنش های جایگزینی چنین مکانیسم صدا. سازوکار اس آر 2.
![]()
جایگزینی رادیکال R-tsії در معطر. هسته ها نیزه ای نمی شوند و مرحله ایجاد رادیکال های سیکلوهگزادینیل را طی می کنند:

معرفی مجدد به محصول dintsevy در نتیجه انتشار N بازگردانده می شود (راه حل 1). فرآیندهای نوترکیبی جانبی (2) و عدم تناسب (3):

واسطه های Electronedonorny و elektronoacceptorny معطر را فعال می کنند. هسته. در واکنش ها وانمود می کنند که متر،і nایزومری با خمیرهای مجدد O-ایزومر
رادیکال های هیدروکسیل که توسط معرف فنتون (H2O2 + Fe2 +) تولید می شوند، معمولاً غیر فعال هستند. معطر هسته. در همان زمان، یک رادیکال وانمود می کند که در حضور Fe 3+ دیمر می شود. برای فنل:

واکنشهای جایگزین رادیکال در آروماتیک هسته عملی ارزش پروتونیر آلکیلووانیا هترو آروماتیک z'єdnan با اتم N در دایره. جایگزینی نمایشگر در اتم های C در موقعیت های 2 و 4.
پیوند Vіlnoradicalnaya فرآیند C = C-lanceyugovy با سینتیک کوتاه. لانتسیوگامی پراکسیدها، انتقال و تشخیص UV را معرفی کنید. P-tsya استری انتخابی نیست. استریو انتخابی بالا ( ترنس-پذیرش) برای. Eمن 40 کیلوژول بر مول را نمی پیچم.
برای رادیکال 1-آلکن، آن را روی اتم a-C بنامید، برای مثال:

Vіlno-رادیکال اتصال HBr به ایدهای نامتقارن در برابر. شایان ذکر است که در صورت حمله به چنین واکنش الفینی، راهی برای ایجاد یک رادیکال پایدار بزرگتر (افزایش تعداد مدافعان الکلی در مرکز رادیکال افزایش پایداری رادیکال) وجود دارد. کمترین. گوستینی الکترونیکی در مولکول ها، به عنوان مثال:






